Ngành dược tiếp tục duy trì sự phát triển ổn định, với sự tăng trưởng nhẹ trong sản xuất và nhập khẩu dược phẩm, đặc biệt là trong kênh ETC nhờ các chính sách ưu đãi. Mặc dù ngành vẫn phụ thuộc vào thuốc nhập khẩu, nhưng mục tiêu đến năm 2030 là tăng sản xuất trong nước để đáp ứng 80% nhu cầu dược phẩm.
Các yếu tố thúc đẩy tăng trưởng bao gồm tăng trưởng kinh tế, nhận thức của người dân về sức khỏe, xu hướng già hóa dân số và các chính sách hỗ trợ của chính phủ. Luật Dược sửa đổi và các chính sách đấu thầu mới sẽ tạo cơ hội cho doanh nghiệp dược nội địa phát triển. Việc đạt chuẩn EU-GMP sẽ là yếu tố quan trọng giúp các doanh nghiệp cạnh tranh và gia tăng thị phần trong các kênh phân phối dược phẩm.
I. NĂM 2024: DƯỢC PHẨM NHẬP KHẨU VÀ SẢN XUẤT ĐỀU TĂNG
- Hoạt động sản xuất dược phẩm và dược liệu tăng nhẹ so với năm 2023. Chỉ số sản xuất công nghiệp IIP (phân ánh tình hình phát triển ngành so với cùng kì) ngành thuốc, hóa dược và dược liệu năm 2024 đạt 107,3 điểm.
- Ngành dược vẫn phụ thuộc vào thuốc và nguyên phụ liệu dược phẩm nhập khẩu. Trong 10T2024, nhập khẩu dược phẩm đạt 3,56 tỷ USD, tăng 26,9% svck; nhập khẩu nguyên phụ liệu dược phẩm đạt 0,39 tỷ USD, tăng 5% svck. Trong đó nhà cung cấp nguyên phụ liệu dược phẩm chính vân là Trung Quốc, với tỷ lệ lên đến 70%, theo sau là Ấn Độ với 17,2%.
- Kênh ETC là động lực tăng trưởng trong năm 2024. Doanh thu các doanh nghiệp dược tăng trưởng trong 9T2024 chủ yếu động lực đến từ kênh ETC nhờ các chính sách ưu tiên dược phẩm sản xuất trong nước trong kênh đấu thầu bệnh viện và việc triển khai bâo hiểm y tế quốc gia
II. NĂM 2025: DUY TRÌ TĂNG TRƯỞNG ỔN ĐỊNH
1. QUY MÔ THỊ TRƯỜNG DƯỢC DỰ KIẾN TIẾP TỤC TĂNG TRƯỞNG
- Tổng giá trị thị trường tăng. Giá trị thị trường dược phẩm Việt Nam tăng từ 3,4 tỉ USD năm 2015 lên đến gần 7 tỉ USD năm 2023. Theo báo cáo của IQVIA (IMS) năm 2023, tăng trưởng chung toàn thị trường dược phẩm là 8%. IQVIA dự báo ngành dược Việt Nam sẽ tiếp tục tăng trưởng vói tốc độ CAGR 6%-8% trong giai đoạn 2023-2028, chi phí chăm sóc sức khỏe/đầu người dự kiến tăng từ 237 USD lên 328 USD trong giai đoạn này. Hiện tại thị trường dược phẩm Việt Nam là thị trường lớn thứ hai khu vực Đông Nam Á, chỉ sau Indonesia.
- Phấn đấu tăng sàn xuất thuốc trong nước. Hiện nay thuốc sàn xuất trong nước đáp ứng được khoảng 60% nhu cầu. Mục tiêu đặt ra trong chiến lược quốc gia phát triển ngành dược phấn đấu đến năm 2030 thuốc sản xuất trong nước đáp ứng được 80% nhu cầu sử dụng và 70% giá trị thị trường. Tiếp tục phấn đấu đạt mục tiêu sản xuất được 20% nhu cầu nguyên liệu cho sản xuất thuốc trong nước và trở thành trung tâm sản xuất dược phẩm giá trị cao trong khu vực.
2. NGÀNH DƯỢC VIỆT NAM KỲ VỌNG TIẾP TỤC TĂNG TRƯỞNG DO 4 YẾU TỐ CHÍNH
- Tăng trưởng kinh tế và tăng thu nhập. Tốc độ tăng trưởng GDP năm 2024 được dự báo ở mức 6,8% và mục tiêu tăng trưởng năm 2025 ở mức 6,5-7%, với GDP đầu người tăng từ 4.300 USD năm 2023 lên mức dự kiến 4.900 USD năm 2025 sẽ tăng khả năng chi tiêu cho sức khỏe của người dân.
- Nhận thức của người dân về các vấn đề sức khỏe cũng đã tăng. Theo nghiên cứu của Roland Berger năm 2023, 78% người được hỏi sẵn sàng chi tiêu thêm cho các sản phẩm và dịch vụ chăm sóc sức khỏe, phản ánh xu hướng tăng tiêu dùng trong ngành này.
- Xu hướng già hóa dân số. Việt Nam hiện là một trong các quốc gia có tốc độ già hóa dân số nhanh nhất thế giới, với quy mô dân số hơn 100 triệu người, số người từ 60 tuổi trở lên chiếm 13,9% năm 2023 và đến năm 2050, con số này được dự báo sẽ tăng lên hơn 25%. Năm 2036, Việt Nam sẽ bước vào thời kỳ dân số già, chuyển từ xã hội “già hóa” sang xã hội “già”. Những người cao tuổi thường có nhu cầu sử dụng dược phẩm và dịch vụ chăm sóc sức khỏe cao hơn, do ảnh hưởng của quá trình lão hóa và các vấn đề sức khỏe liên quan.
- Các chính sách hỗ trợ của chính phủ thúc đẩy phát triển sản xuất dược nội địa, giảm phụ thuộc vào thuốc nhập và tăng cường đầu tư nghiên cứu và phát triển.
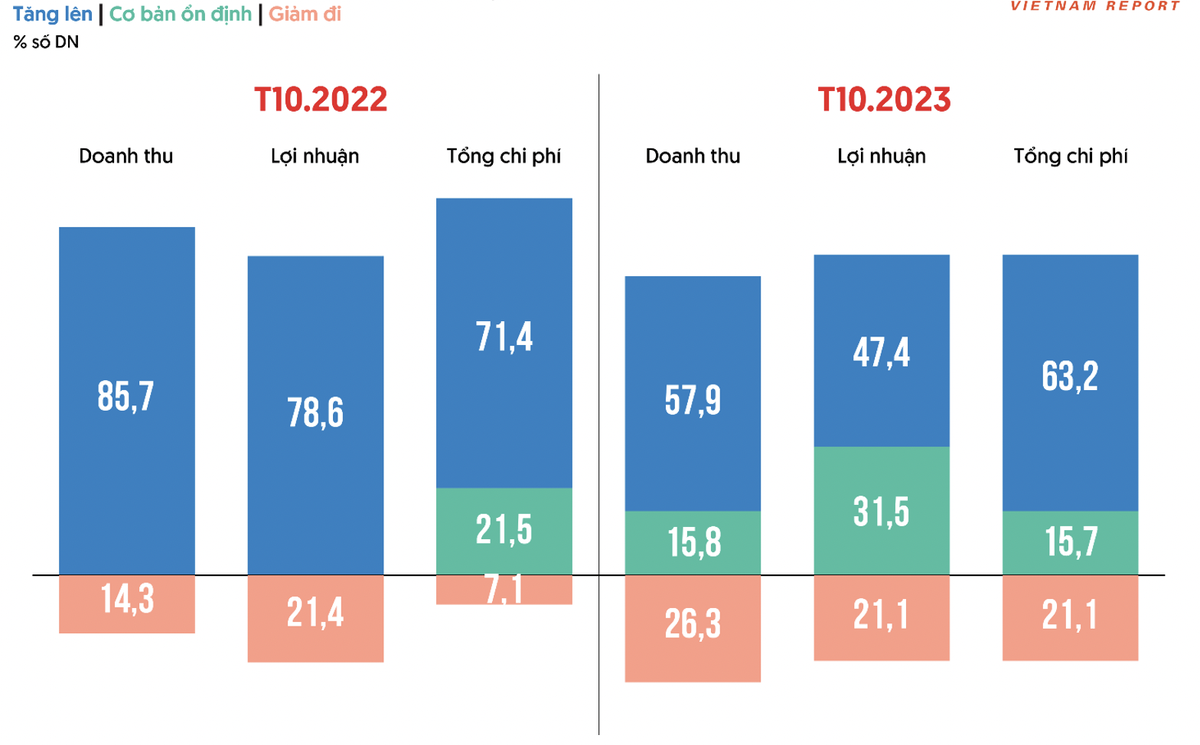
III. TĂNG TRƯỞNG ỔN ĐỊNH
IV. CÁC CHÍNH SÁCH CỦA NHÀ NƯỚC THÚC ĐẨY PHÁT TRIỂN NGÀNH DƯỢC VIỆT NAM
Năm 2024, nhiều văn bàn quy phạm pháp luật, nhiều chính sách liên quan ngành dược đã được ban hành, trong đó nổi bật là Luật dược sửa đổi được Quốc hội thông qua ngày 21/11/2024 và chính thức có hiệu lực từ ngày 1/7/2025. Nhiều quy định mới, nhiều ưu đãi giúp tinh gọn thủ tục, giúp cởi trói cho doanh nghiệp dược, tiết kiệm thời gian, chi phí, giúp người dân tiếp cận thuốc dễ dàng hơn...
1. CÁC ĐIỂM MỚI TRONG LUẬT DƯỢC SỬA ĐỔI
- Ưu tiên thủ tục hành chính khi cấp giấy đăng ký lưu hành, cấp phép nhập khẩu trong ngành dược và đẩy mạnh cài cách thủ tục hành chính trong đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Điều này sẽ giúp làm giảm thời gian chờ đợi của các doanh nghiệp dược, giúp thuốc đạt tiêu chuẩn được cấp phép và đưa ra thị trường một cách nhanh chóng.
- Thực hiện chính sách ưu đãi, hỗ trợ đầu tư đối vói các dự án đầu tư trong lĩnh vực dược phẩm theo quy định của pháp luật về đầu tư. Điều này có khả năng sẽ thu hút được các doanh nghiệp chuyển hướng từ việc nhập khẩu và bán thuốc sang sản xuất thuốc tại Việt Nam.
- Tạo hành lang pháp lý cho các hình thức, phương thức kinh doanh mới (chuỗi nhà thuốc, thuốc thương mại điện tử). Các chuỗi nhà thuốc phát triển cả online và offline sẽ góp phần rất lớn trong việc phân phối thuốc đến tay nhiều người tiêu dùng, tăng doanh số cho ngành. Hiện nay phương thức kinh doanh mói này đâ trở thành xu thế phát triển, có khả năng thay thế dần các cửa hàng thuốc nhỏ lẻ. Việc có được hành lang pháp lý sẽ giúp chuỗi nhà thuốc phát triển đúng định hướng, quân lý được chất lượng thuốc và bâo vệ người tiêu dùng.
- Cụ thể hóa quyền và trách nhiệm của cơ sở kinh doanh dược có vốn đâu tư nước ngoài. Luật Dược sửa đổi đã thêm quyền cho các doanh nghiệp này được phép tham gia vào hoạt động phân phối dược phẩm, giúp tạo điều kiện thuận lợi cho việc lưu thông, mua bán thuốc. Đồng thời, hoạt động chuyển giao công nghệ cũng có cơ hội phát triển khi các doanh nghiệp có vốn đầu tư nước ngoài có thể phân phối thuốc do bên nhận chuyển giao công nghệ sản xuất.
- Các biện pháp quàn lý về giá để phù hợp với Luật Giá: quy định về công bố giá bán buôn thuốc để tránh việc nâng giá bán qua mỗi khâu trung gian, từ đó đâm bâo thuốc đến tay người tiêu dùng không bị đẩy giá.
2. LUẬT ĐẤU THẦU NĂM 2023 (CÓ HIỆU LỰC THI HÀNH TỪ NGÀY 1/1/2024) QUY ĐỊNH ƯU TIÊN THUỐC SẢN XUẤT TRONG NƯỚC
Theo quy định của Luật, những sản phẩm nằm trong danh mục thuốc được Bộ Y tế công bố có ít nhất 3 hãng trong nước sân xuất đáp ứng tiêu chí kỹ thuật, chất lượng và giá cả, thì chủ đầu tư quyết định việc yêu câu nhà thâu chào thuốc xuất xứ trong nước. Thuốc được Bộ Y tế công bố có ít nhất 3 hãng trong nước sân xuất trên dây chuyền sản xuất thuốc đáp ứng tiêu chuẩn EU GMP hoặc tương đương EU GMP và đáp ứng tiêu chí kỹ thuật, chất lượng, giá cả, khả năng cung cấp thì chủ đầu tư chỉ yêu càu chào thuốc xuất xứ trong nước.
IV. CÁC DOANH NGHIỆP HƯỚNG TỚI CHỨNG NHẬN EU-GMP ĐỂ NÂNG CAO CẠNH TRANH
CÁC DOANH NGHIỆP DƯỢC TRONG NƯỚC ĐANG TÍCH CỰC XÂY DỰNG, NÂNG CẤP NHÀ MÁY ĐẠT TIÊU CHUẨN EU-GMP ĐỂ TẬN DỤNG ƯU ĐÃI VÀ VƯƠN TỚI XUẤT KHẨU

- Chỉ những nhà thầu có thuốc đạt nguyên tắc, tiêu chuẩn EU GMP hoặc tương đương EU GMP mới được tham gia đấu thầu thuốc đó ở nhóm 1 và 2. Giá trị nhóm thuốc 1 & 2 đang chiếm đến 60% doanh thu thuốc trúng thuầu tuy nhiên thị phần chính của nhóm này đang thuộc về các doanh nghiệp dược nước ngoài đáp ứng tiêu chuẩn sân xuất cao.
- Chính sách ưu tiên chỉ chọn các nhà thầu chào thuốc xuất xứ trong nước đối với các thuốc được Bộ Y tế công bố có ít nhất 3 hãng trong nước sân xuất trên dây chuyền sân xuất thuốc đáp ứng tiêu chuẩn EU GMP hoặc tương đương EU GMP sẽ mở đường cho các doanh nghiệp thuốc sân xuất trong nước giành thị phần của thuốc nhập khẩu.
- Theo danh sách của Cục Quản lý Dược, 10 tháng đầu năm 2024 trên cả nước đã có thêm 3 cơ sở sản xuất thuốc được cấp chứng nhận EU GMP (hoặc tương đương), nâng tổng số cơ sở sân xuất thuốc đạt tiêu chuẩn EU GMP (hoặc tương đương) lên 25 cơ sở. Hiện nay các nhà máy, dự án theo tiêu chuẩn EU GMP đang được tiếp tục xây dựng, hoàn thiện và xin chứng nhận.
- Các công ty dược lớn có sẵn dây chuyền sân xuất đạt tiêu chuẩn EU GMP đã bắt đầu tận dụng được lợi thế và gia tăng thị phần trong kênh thuốc bệnh viện.
- Imexpharm với 11 dây chuyền sân xuất đạt tiêu chuẩn EU GMP có doanh thu kênh ETC tăng trưởng vượt trội trong năm 2024. Theo báo cáo của doanh nghiệp, doanh thu thuần 11T/2024 đạt 1.967 tỷ đồng, (+10% svck), trong đó doanh thu kênh ETC tăng trưởng đến 54% svck chủ yếu nhờ vào các sân phẩm thuốc tiêm có giá trị cao theo tiêu chuẩn EU GMP.
Trải qua 14 năm hình thành và phát triển, với văn phòng tại Hà Nội và TP Hồ Chí Minh, GMPc Việt Nam đã nhận được sự tin tưởng của hầu hết các Chủ đầu tư nhà máy GMP trên toàn quốc với gần 300 Công trình Nhà máy sản xuất đạt chứng nhận GMP/GPs, chiếm hơn 80% tổng số các dự án được đầu tư trong giai đoạn 2011-2025!. Tất cả các chủ đầu tư đều hài lòng và được cơ quản quản lý nhà nước đánh giá rất cao. Hàng trăm đối tác, các thương hiệu, nhà máy GMP hàng đầu Việt Nam đều lựa chọn GMPc Việt Nam làm nhà tư vấn như: Dược Hậu Giang, Mỹ phẩm Linh Hương, TopWhite, Đăng Dương, Dược phẩm Codupha, Hapharco, Mediplantex….
Quý khách hàng có nhu cầu tư vấn xây dựng nhà máy dược phẩm tiêu chuẩn EU GMP vui lòng liên hệ với chúng tôi qua Email: contact@gmp.com.vn hoặc gọi đến Hotline CEO: 0982.866.668 để được hỗ trợ tốt nhất.
Tư vấn xây dựng nhà máy Dược phẩm EU GMP
Tư vấn xây dựng nhà máy Dược phẩm WHO GMP
Kinh nghiệm xây dựng và duy trì nhà máy dược phẩm tiêu chuẩn cao
Danh sách dự án nhà máy Dược phẩm được GMPc Việt Nam tư vấn
Công ty Cổ phần GMPc Việt Nam
- Trụ sở chính (Hà Nội): Số 32, Đường Vĩ Cầm 5, KĐT An Lạc Green Symphony, Vân Canh, Hoài Đức
- VPĐD tại thành phố HCM: Lầu 2 – Số 156/1/1 Cộng Hòa, Phường 12, Quận Tân Bình
- Tel: 0243.787.2242 | Hotline: 0982.866.668
- Website: gmp.com.vn






