I. Tổng quan thị trường dược phẩm Việt Nam 2020–2025
Giai đoạn 2020–2025 đánh dấu sự phát triển mạnh mẽ của thị trường dược phẩm Việt Nam, với quy mô ước đạt khoảng 7 tỷ USD vào năm 2023 và dự kiến chạm mốc 8 tỷ USD trong năm 2024, theo dữ liệu từ IQVIA. Tốc độ tăng trưởng kép hằng năm (CAGR) được dự báo dao động từ 6–8% trong giai đoạn 2023–2028. Động lực tăng trưởng đến từ nhu cầu chăm sóc sức khỏe ngày càng cao, quá trình già hóa dân số, cùng với các chính sách hỗ trợ ngành y tế và định hướng nâng cao năng lực sản xuất dược phẩm trong nước. Những yếu tố này không chỉ thúc đẩy thị trường nội địa mà còn mở ra cơ hội để ngành dược Việt Nam tiến tới tự chủ, hiện đại hóa và hội nhập sâu vào chuỗi giá trị toàn cầu.
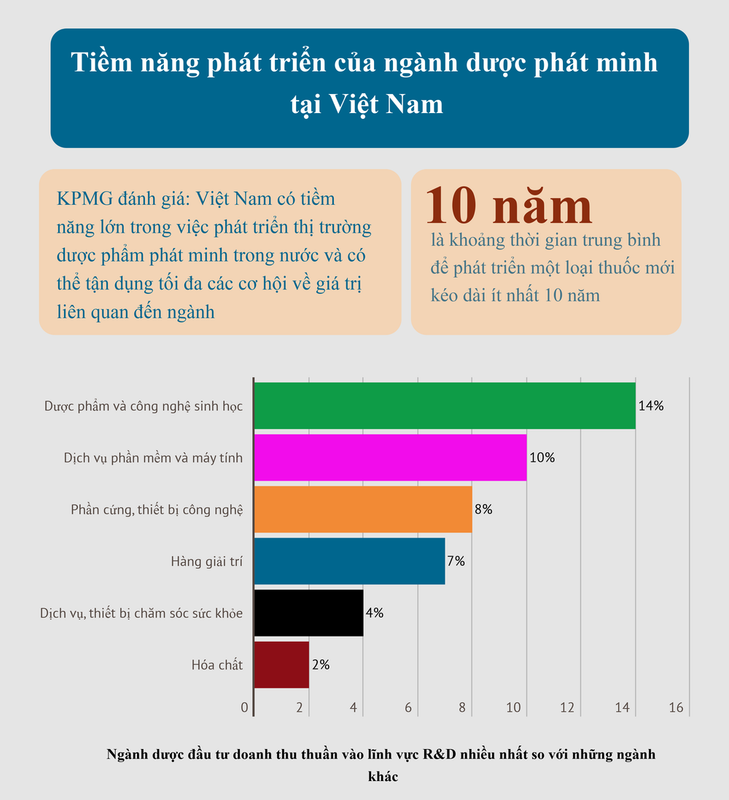
1.1. Quy mô tăng trưởng ngành dược Việt Nam
Quy mô thị trường dược phẩm Việt Nam đã ghi nhận những con số ấn tượng. Theo dữ liệu từ IQVIA, thị trường đạt khoảng 7 tỷ USD vào năm 2023 và ước tính 8 tỷ USD vào năm 2024. Tổ chức này cũng dự báo tốc độ tăng trưởng kép hàng năm (CAGR) cho giai đoạn 2023-2028 là từ 6-8%. Fitch Solutions đưa ra một dự báo lạc quan hơn, cho rằng thị trường có thể đạt 16,1 tỷ USD vào năm 2026. Một số nguồn khác như Statista có thể đưa ra con số thấp hơn, ví dụ 2,40 tỷ USD cho năm 2024 , sự khác biệt này có thể xuất phát từ phương pháp luận và phạm vi thống kê khác nhau (ví dụ, có bao gồm vaccine, thiết bị y tế hay không, hoặc chỉ tính thị trường dược phẩm bán lẻ).
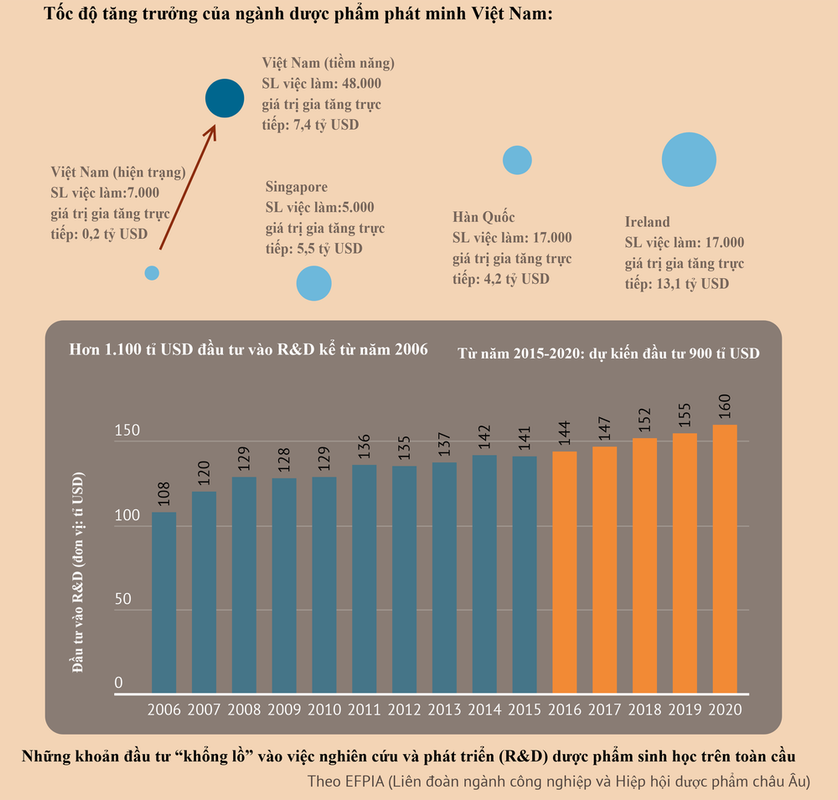
1.2. Các phân khúc chính của thị trường
- Thuốc kê đơn (ETC) và Thuốc không kê đơn (OTC): Kênh ETC (thuốc điều trị tại bệnh viện) chiếm phần lớn doanh thu, khoảng 75-76% tổng giá trị thị trường. Doanh thu thuốc kê đơn được dự báo đạt 5,7 tỷ USD vào năm 2025, chiếm 76,6% tổng doanh thu bán thuốc, với tốc độ CAGR (2020-2025) là 8,4%. Doanh số bán thuốc kê đơn tại Việt Nam ước đạt 124.000 tỷ đồng năm 2023.
- Thuốc sản xuất trong nước và Thuốc nhập khẩu: Thuốc nhập khẩu vẫn chiếm ưu thế về giá trị thị trường, với khoảng 58% thị phần tính đến quý 3/2024, trong khi dược phẩm sản xuất trong nước chiếm 42%. Tuy nhiên, về số lượng, sản xuất trong nước đáp ứng một phần đáng kể nhu cầu, khoảng 60-70% , thậm chí một báo cáo cho thấy 80,2% số lượng đơn vị liều dùng xác định hàng ngày (DDD) kháng sinh là thuốc sản xuất trong nước. Chính phủ đặt mục tiêu tăng tỷ trọng thuốc sản xuất trong nước lên 80% nhu cầu sử dụng và 70% giá trị thị trường vào năm 2030.
II. Chính sách và chiến lược phát triển ngành dược
2.1. Luật Dược sửa đổi 2024 (hiệu lực từ 1/7/2025)
Luật Dược sửa đổi mang đến những cải cách quan trọng:
- Nới lỏng hạn chế đối với doanh nghiệp có vốn đầu tư nước ngoài (FIEs): Cho phép họ tham gia sâu hơn vào chuỗi cung ứng dược phẩm tại Việt Nam.
- Đơn giản hóa thủ tục đăng ký thuốc: Rút ngắn thời gian phê duyệt, tạo điều kiện thuận lợi cho doanh nghiệp đưa sản phẩm ra thị trường.
- Quy định rõ ràng về quyền và trách nhiệm của FIEs: Tạo môi trường pháp lý ổn định hơn, thu hút đầu tư nước ngoài vào ngành dược.
2.2. Chiến lược quốc gia phát triển ngành Dược đến 2030, tầm nhìn 2045

Chiến lược này đặt ra các mục tiêu cụ thể:
- Đáp ứng 80% nhu cầu thuốc trong nước: Chiếm 70% giá trị thị trường vào năm 2030.
- Phát triển sản phẩm công nghệ cao: Như thuốc sinh học, vaccine và thuốc điều trị ung thư, thông qua chuyển giao công nghệ từ các đối tác quốc tế.
- Khuyến khích đầu tư vào nhà máy đạt chuẩn GMP-EU: Xây dựng khu công nghiệp dược phẩm quy mô lớn, nâng cao năng lực sản xuất trong nước.
2.3 Chính sách đấu thầu mới
Các chính sách đấu thầu mới (ví dụ, Thông tư 03/2024, 07/2024) ưu tiên các công ty trong nước đạt tiêu chuẩn EU-GMP, có khả năng hạn chế việc nhập khẩu nếu nguồn cung trong nước đáp ứng đủ yêu cầu cho một số nhóm thuốc nhất định.
Việc chính phủ tập trung đồng thời vào việc thu hút các doanh nghiệp FDI để chuyển giao công nghệ cao và củng cố các nhà sản xuất trong nước đạt chuẩn EU-GMP tạo ra một động lực cạnh tranh phức tạp. Các doanh nghiệp FDI có thể tìm thấy nhiều cơ hội hơn trong các lĩnh vực mà năng lực trong nước còn non trẻ (ví dụ: thuốc sinh học mới, liệu pháp gen), trong khi các công ty trong nước có EU-GMP có thể tận dụng lợi thế đấu thầu đối với các thuốc generic đã có uy tín và có khả năng là cả thuốc biosimilar. Điều này cho thấy một chiến lược tiếp cận thị trường theo từng cấp độ cho các loại hình doanh nghiệp khác nhau. Trong khi FDI được khuyến khích cho các công nghệ mới và thuốc phát minh, các công ty trong nước đang được trao quyền để cạnh tranh mạnh mẽ hơn trong không gian thuốc generic/biosimilar chất lượng cao, đã được thiết lập. Cơ hội cho FDI có thể tập trung nhiều hơn vào các sản phẩm thực sự đổi mới, lần đầu tiên có mặt trên thị trường, nơi năng lực địa phương vẫn đang phát triển, trong khi sự cạnh tranh sẽ gia tăng đối với các sản phẩm mà các công ty trong nước có thể đáp ứng các tiêu chí về chất lượng và cung ứng.
III. Thách thức và cơ hội cho doanh nghiệp dược nội địa
Thị trường dược phẩm Việt Nam mang lại nhiều cơ hội nhưng cũng không thiếu những thách thức.

3.1. Thách thức ngành dược Việt Nam
- Phụ thuộc vào nguyên liệu nhập khẩu: Khoảng 85% nguyên liệu hoạt chất (API) được nhập khẩu từ Trung Quốc và Ấn Độ, khiến ngành dược dễ bị ảnh hưởng bởi biến động thị trường quốc tế.
- Thiếu cơ sở hạ tầng sản xuất hiện đại: Chỉ có khoảng 31 nhà máy đạt chuẩn EU-GMP trong tổng số 288 cơ sở sản xuất thuốc, hạn chế khả năng cạnh tranh với các doanh nghiệp nước ngoài.
- Hạn chế về năng lực R&D: Đa số doanh nghiệp trong nước là vừa và nhỏ, thiếu nguồn lực đầu tư vào nghiên cứu và phát triển, dẫn đến sự phụ thuộc vào thuốc generic và thiếu vắng các sản phẩm sáng tạo.
3.2. Cơ hội cho ngành dược Việt Nam
- Chính sách ưu đãi của chính phủ: Hỗ trợ tài chính và ưu đãi thuế cho các dự án đầu tư vào R&D và sản xuất thuốc công nghệ cao.
- Tăng cường hợp tác quốc tế: Khuyến khích chuyển giao công nghệ và hợp tác giữa doanh nghiệp trong nước và các tập đoàn dược phẩm đa quốc gia, như hợp tác giữa Imexpharm và Genuone Sciences Inc
- Phát triển thị trường xuất khẩu: Tham gia vào chuỗi cung ứng dược phẩm toàn cầu, đặc biệt là trong lĩnh vực thuốc sinh học và vaccine.
IV. Xu hướng phát triển ngành dược Việt Nam giai đoạn 2025 – 2030

4.1. Tăng tốc tự chủ dược phẩm – Nội địa hóa sản xuất
- Mục tiêu chiến lược đến năm 2030: thuốc sản xuất trong nước đáp ứng ít nhất 80% nhu cầu sử dụng và 70% giá trị thị trường.
- Chính phủ khuyến khích chuyển giao công nghệ sản xuất thuốc phát minh, thuốc sinh học, vaccine cho doanh nghiệp nội.
- Các doanh nghiệp trong nước sẽ tập trung đầu tư vào nhà máy đạt chuẩn GMP-EU, thay vì chỉ dừng lại ở WHO-GMP như giai đoạn trước.
4.2. Ưu tiên phát triển thuốc công nghệ cao và chuyên khoa đặc trị
- Tăng tỷ trọng sản xuất và đấu thầu nhóm thuốc có giá trị cao như:
+ Thuốc sinh học (biologic drugs)
+ Thuốc điều trị ung thư, nhắm trúng đích, miễn dịch
+ Biosimilar và vaccine thế hệ mới
- Định hướng chiến lược quốc gia nhấn mạnh vào việc phát triển sản phẩm công nghệ cao thay thế biệt dược gốc, mở rộng phạm vi bệnh điều trị.
4.3. Chuẩn hóa hệ thống sản xuất theo tiêu chuẩn quốc tế
- Nhà máy cần đạt các chuẩn GMP-EU, GMP-PIC/s, thậm chí hướng đến các chuẩn cao hơn (FDA, TGA… nếu xuất khẩu).
- Phát triển khu công nghiệp dược phẩm tập trung với quy mô lớn như Thái Bình, Cần Thơ, Bình Dương…
- Ứng dụng tự động hóa – số hóa – quản trị chất lượng toàn diện (QMS) trong sản xuất.
Xem thêm: Tư vấn xây dựng nhà máy dược phẩm tiêu chuẩn EU GMP
4.4. Tăng cường hợp tác quốc tế – chuyển giao công nghệ
- Hợp tác với các tập đoàn dược đa quốc gia để:
+ Chuyển giao công nghệ sản xuất thuốc phát minh
+ Liên doanh sản xuất biosimilar
+ Tham gia chuỗi thử nghiệm lâm sàng toàn cầu
- Các mô hình như: Imexpharm – Genuone, AstraZeneca – DHG, Viatris – Traphaco… sẽ ngày càng phổ biến.
4.5. Thúc đẩy R&D trong nước và phát triển thuốc nội hóa
- Chính phủ khuyến khích doanh nghiệp đầu tư vào:
+ Trung tâm R&D chuyên biệt
+ Công nghệ sản xuất API
+ Phát triển thuốc mới và thử nghiệm lâm sàng nội địa
- Hình thành hệ sinh thái đổi mới sáng tạo trong ngành dược – kết nối giữa viện nghiên cứu, trường đại học, doanh nghiệp sản xuất.
V. Kết luận
Trong suốt giai đoạn 2020–2025, ngành dược phẩm Việt Nam đã chứng kiến sự chuyển mình rõ nét – từ một thị trường phụ thuộc nhiều vào nhập khẩu, nay đang từng bước tiến tới tự chủ về sản xuất và nâng cao năng lực cạnh tranh. Với tốc độ tăng trưởng ổn định, quy mô thị trường ngày càng mở rộng, cùng những định hướng chính sách sâu rộng từ Chính phủ, dược phẩm đã trở thành lĩnh vực kinh tế được đặt nhiều kỳ vọng trong chiến lược phát triển quốc gia.
Dẫu vậy, phía trước vẫn còn không ít thách thức. Để có thể đón đầu các xu hướng mới như thuốc sinh học, thuốc nhắm trúng đích hay sản phẩm công nghệ cao, các doanh nghiệp trong nước cần chủ động đầu tư bài bản vào hạ tầng sản xuất, đặc biệt là xây dựng nhà máy đạt chuẩn GMP quốc tế, tăng cường chuyển giao công nghệ, cũng như chuẩn hóa quy trình từ thiết kế đến vận hành.
Việc lựa chọn đúng đối tác tư vấn ngay từ đầu sẽ là yếu tố quyết định giúp doanh nghiệp tiết kiệm thời gian, chi phí và giảm thiểu rủi ro trong quá trình triển khai.
Trong bối cảnh đó, GMPc Việt Nam tự hào là đơn vị chuyên sâu trong lĩnh vực tư vấn thiết kế – xây dựng – thẩm định nhà máy đạt chuẩn GMP, đồng hành cùng nhiều doanh nghiệp trong nước và quốc tế thực hiện các dự án sản xuất thuốc chuyên khoa và các dây chuyền sản phẩm có giá trị cao.
Với 14 năm kinh nghiệm thực tiễn và đội ngũ chuyên gia tận tâm, GMPc cam kết mang đến giải pháp tổng thể – từ ý tưởng đến vận hành – giúp doanh nghiệp nâng cao năng lực sản xuất, đáp ứng các tiêu chuẩn quốc tế và từng bước khẳng định vị thế trên thị trường dược phẩm trong nước và khu vực.







