Chặng đường phát triển của ngành dược Việt Nam là một hành trình đầy cam go nhưng cũng vô cùng ấn tượng. Từ một nền công nghiệp non trẻ, chủ yếu sản xuất theo tiêu chuẩn nội bộ, ngành dược đã từng bước chuyển mình, vươn lên đáp ứng các chuẩn mực quốc tế. Trong đó, việc áp dụng Thực hành sản xuất tốt (GMP) không chỉ là một quy định bắt buộc mà còn là một cuộc cách mạng về chất lượng. GMP là một hệ thống kiểm soát và đảm bảo các sản phẩm y tế được sản xuất đồng nhất và kiểm soát theo các tiêu chuẩn chất lượng, giúp giảm thiểu rủi ro cho người tiêu dùng, nhà sản xuất và nhà phân phối.
CHƯƠNG I: LỘ TRÌNH LỊCH SỬ VÀ CHUYỂN MÌNH CỦA NGÀNH DƯỢC VIỆT NAM
1.1. Giai đoạn I: Yêu cầu ban đầu và việc áp dụng sớm (Sau năm 2004)
Hành trình chính thức của GMP tại Việt Nam bắt đầu với việc ban hành các quy định ban đầu, cụ thể là yêu cầu các nhà sản xuất phải đạt chứng nhận WHO GMP. Giai đoạn này được đặc trưng bởi một cách tiếp cận tự nguyện, dựa trên các ưu đãi. Chỉ một số nhà sản xuất, thường là những công ty có nguồn lực lớn hơn hoặc có định hướng xuất khẩu, đã chủ động áp dụng các tiêu chuẩn này. Việc tuân thủ GMP trong giai đoạn này được coi là một lợi thế cạnh tranh, cho phép các công ty tiếp cận các kênh phân phối mới hoặc nâng cao uy tín trên thị trường nội địa. Tuy nhiên, sự thiếu hụt một quy định bắt buộc đã dẫn đến tốc độ áp dụng chậm và không đồng đều, tạo ra một sự phân hóa rõ rệt về chất lượng giữa các doanh nghiệp.
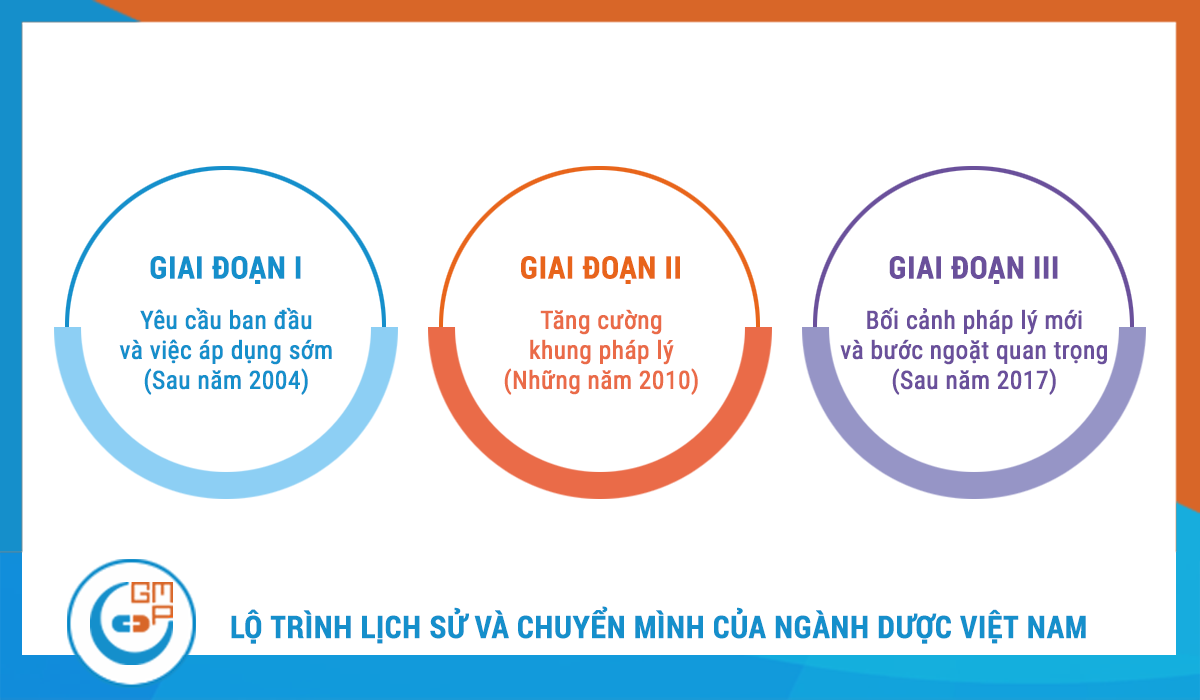
1.2. Giai đoạn II: Tăng cường khung pháp lý (Những năm 2010)
Trong giai đoạn này, chính phủ đã dần dần thắt chặt các yêu cầu thông qua việc ban hành các thông tư và nghị định khác nhau. Mặc dù vẫn chưa có một lệnh cấm tuyệt đối đối với các nhà máy không đạt chuẩn, những văn bản pháp lý này đã gửi đi một tín hiệu mạnh mẽ về cam kết dài hạn của chính phủ đối với việc nâng cao chất lượng toàn ngành. Các quy định được ban hành trong giai đoạn này đã dần dần xây dựng một nền tảng pháp lý vững chắc, chuẩn bị cho bước ngoặt lớn nhất của ngành.
1.3. Giai đoạn III: Bối cảnh pháp lý mới và bước ngoặt quan trọng (Sau năm 2017)
Đây là giai đoạn mang tính quyết định, được đánh dấu bằng sự ra đời của các văn bản pháp lý quan trọng.
Phân tích chuyên sâu Nghị định 54/2017/NĐ-CP và Thông tư 35/2018/TT-BYT
Nghị định 54/2017/NĐ-CP và Thông tư 35/2018/TT-BYT là những văn bản pháp lý mang tính bước ngoặt. Chúng đã thiết lập yêu cầu tuân thủ WHO GMP bắt buộc trên toàn quốc cho tất cả các cơ sở sản xuất dược phẩm. Các văn bản này đưa ra các mốc thời gian rõ ràng, ví dụ, tất cả các cơ sở phải đạt chuẩn vào cuối năm 2019, nếu không sẽ không được tiếp tục sản xuất và lưu hành thuốc.
Việc ban hành các văn bản này đánh dấu một sự thay đổi chiến lược từ chính sách "kéo" sang chính sách "đẩy." Trước năm 2017, việc áp dụng GMP chủ yếu được thúc đẩy bởi một chiến lược "kéo," nơi các công ty được khuyến khích tuân thủ để có lợi thế cạnh tranh. Kết quả là một tốc độ áp dụng chậm và không đồng đều. Nhận thấy rằng một bộ phận đáng kể của ngành, đặc biệt là các công ty nội địa nhỏ hơn, không tiến bộ đủ nhanh, chính phủ đã chuyển sang một chiến lược "đẩy" hoặc "mệnh lệnh." Việc tuân thủ trở thành điều kiện tiên quyết để tiếp tục hoạt động. Những mốc thời gian đã trở thành một "lực thúc đẩy," sàng lọc các nhà sản xuất không tuân thủ và buộc những đơn vị còn lại phải đầu tư mạnh vào chất lượng. Sự thay đổi pháp lý này là chất xúc tác quan trọng nhất trong hành trình GMP của Việt Nam. Nó thay đổi cơ bản bối cảnh cạnh tranh và tạo nền tảng cho giai đoạn phát triển tiếp theo.
CHƯƠNG II: BỨC TRANH TOÀN CẢNH NGÀNH DƯỢC VIỆT NAM - THÁCH THỨC VÀ TẦM NHÌN TƯƠNG LAI
2.1. Tổng quan các cơ sở tuân thủ GMP
Dữ liệu cho thấy sự tăng trưởng mạnh mẽ về số lượng các cơ sở sản xuất đạt chuẩn WHO GMP, đặc biệt sau bước ngoặt chính sách vào năm 2017.
| Năm |
Số cơ sở đạt WHO GMP |
Số cơ sở đạt EU GMP hoặc tương đương |
Tổng số cơ sở đạt GMP
|
| 2010 |
54 |
Không có dữ liệu |
54
|
| 2018 |
185 |
11 |
199
|
| 2021 |
222 |
12 |
237
|
| 2023 |
240 |
14 |
258
|
| 2025 |
294 |
28 |
322
|
Bảng 1: Sự Phát triển của các Cơ sở Tuân thủ GMP tại Việt Nam (2010 - Hiện tại)
Dữ liệu trên cho thấy sự tăng trưởng vượt bậc về số lượng cơ sở đạt WHO GMP, với con số tăng từ 54 vào năm 2010 lên 222 vào năm 2021. Sự gia tăng mạnh mẽ này phản ánh phản ứng của ngành đối với các quy định bắt buộc sau năm 2017. Tuy nhiên, cùng lúc đó, số lượng các cơ sở đạt các tiêu chuẩn cao hơn như EU GMP và PIC/S GMP vẫn còn rất khiêm tốn, chỉ tăng từ 11 lên 12 (EU GMP) và giữ nguyên 3 (PIC/S GMP) trong cùng giai đoạn. Điều này cho thấy trong khi ngành đã thành công trong việc tạo ra một nền tảng chất lượng cơ bản, việc tiến tới các tiêu chuẩn quốc tế cao hơn vẫn là một thách thức lớn.
2.2. Phân tích các phân khúc thị trường chính
Doanh nghiệp trong nước so với doanh nghiệp có vốn đầu tư nước ngoài
Phân tích dữ liệu về thị trường cho thấy một sự phân chia rõ ràng. Mặc dù các công ty nội địa sản xuất 52% tổng sản lượng thuốc tại Việt Nam, các công ty nước ngoài lại chiếm tới 60% tổng giá trị thị trường. Sự chênh lệch này không phải ngẫu nhiên mà có mối liên hệ trực tiếp với các tiêu chuẩn GMP. Số lượng các cơ sở đạt EU GMP và PIC/S GMP rất thấp, và phần lớn các cơ sở này thuộc sở hữu của các công ty đa quốc gia hoặc các doanh nghiệp trong nước lớn có đủ tiềm lực tài chính để đầu tư vào cơ sở vật chất và công nghệ. Các tiêu chuẩn cao hơn này cho phép các công ty sản xuất các loại thuốc đặc trị, thuốc gốc hoặc thuốc có công nghệ phức tạp hơn, vốn có giá trị cao hơn đáng kể so với các loại thuốc generic thông thường mà phần lớn các nhà sản xuất trong nước đang sản xuất. Do đó, việc chuyển đổi sang các tiêu chuẩn GMP tiên tiến không chỉ là một gánh nặng chi phí mà còn là chìa khóa chiến lược để các công ty nội địa thoát khỏi mô hình kinh doanh dựa vào sản lượng lớn với biên lợi nhuận thấp và cạnh tranh trong phân khúc thị trường có giá trị cao.
2.3. Chiến lược quốc gia phát triển ngành dược Việt Nam
Mặc dù đã có những thành tựu, ngành dược Việt Nam vẫn đối mặt với những thách thức nội tại. Một trong những điểm nghẽn lớn nhất là sự phụ thuộc vào nguyên liệu nhập khẩu. Thêm vào đó, năng lực sản xuất trong nước vẫn tập trung chủ yếu vào thuốc generic, các loại thuốc đã hết bản quyền, trong khi chưa chú trọng vào các loại thuốc công nghệ cao. Công nghiệp sản xuất thuốc từ dược liệu cũng phức tạp hơn hóa dược, với chất lượng nguyên liệu không đồng đều.
Để giải quyết những vấn đề này, Chiến lược quốc gia phát triển ngành dược Việt Nam giai đoạn đến năm 2030, tầm nhìn đến năm 2045 đã được ban hành.
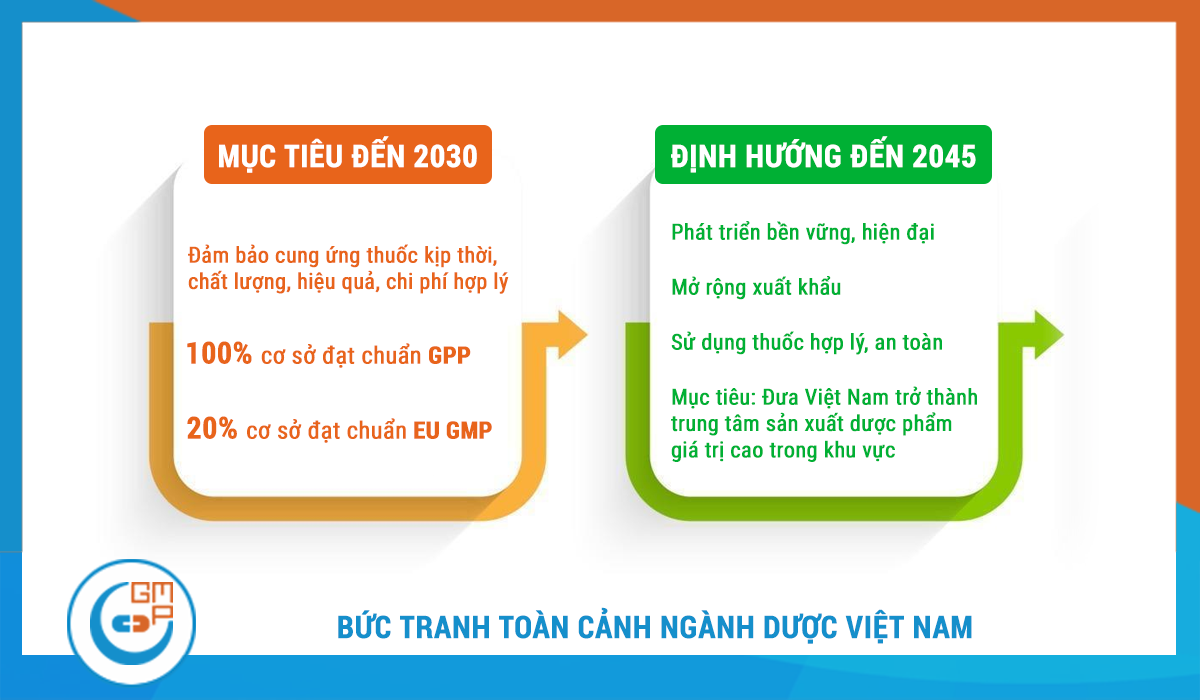
Mục tiêu đến năm 2030:
Đảm bảo cung ứng thuốc kịp thời, chất lượng, an toàn và hiệu quả với chi phí hợp lý.
100% cơ sở kinh doanh thuốc đáp ứng tiêu chuẩn thực hành tốt.
20% cơ sở sản xuất thuốc đạt tiêu chuẩn EU GMP hoặc tương đương.
Định hướng đến năm 2045:
Phát triển bền vững và hiện đại.
Chú trọng an ninh thuốc, phát triển công nghiệp dược và dược liệu.
Gia tăng giá trị xuất khẩu và hội nhập sâu vào chuỗi cung ứng dược phẩm toàn cầu.
Đảm bảo sử dụng thuốc hợp lý, an toàn thông qua các biện pháp đồng bộ, đặc biệt là dược lâm sàng và hệ sinh thái dữ liệu số về dược.
Đưa Việt Nam trở thành trung tâm sản xuất dược phẩm giá trị cao trong khu vực.
Tầm nhìn đầy tham vọng này cho thấy ngành dược đang chuyển mình từ mô hình "tuân thủ" sang "đổi mới". Điều này mở ra một kỷ nguyên mới, đòi hỏi các doanh nghiệp không chỉ xây dựng nhà máy mà còn cần một đối tác tư vấn toàn diện, có khả năng cung cấp giải pháp chiến lược.
Xem đầy đủ tại đây:
Báo cáo nghiên cứu thị trường sản xuất thuốc tại Việt Nam
Báo cáo tiềm năng và định hướng phát triển ngành công nghiệp dược sinh học tại Việt Nam
Báo cáo Chuyên sâu: Triển vọng Đầu tư và Phát triển Ngành Sản xuất Thực phẩm Bảo vệ Sức khỏe tại Việt Nam 2025
CHƯƠNG III: GMPC VIỆT NAM - TƯ VẤN GMP TRỌN GÓI TIÊN PHONG VÀ DẪN ĐẦU
Sự phức tạp và rủi ro trong việc đạt chứng nhận GMP đã tạo ra một khoảng trống lớn trên thị trường, và đó cũng là lúc GMPc Việt Nam ra đời. Được thành lập vào năm 2011, GMPc Việt Nam là minh chứng sống cho tầm nhìn chiến lược của đội ngũ sáng lập, những người đã trực tiếp trải qua những khó khăn khi xây dựng nhà máy GMP hiện đại.
Với sứ mệnh "Cung cấp Giải pháp tư vấn toàn diện, trọn gói, giúp Chủ đầu tư Dự án đầu tư xây dựng Nhà máy GMP chỉ cần duy nhất một Nhà tư vấn cùng song hành", GMPc đã trực tiếp giải quyết những thách thức mà các doanh nghiệp gặp phải. Ba giá trị cốt lõi:
Đơn giản hóa – Tối ưu chi phí – Đảm bảo đạt chứng nhận đã trở thành lời giải cho bài toán của các nhà đầu tư.

GMPc Việt Nam tự hào là đơn vị tiên phong trong mô hình tư vấn trọn gói, bao gồm toàn bộ chu trình dự án, từ lập báo cáo đầu tư, tư vấn lựa chọn công nghệ và thiết bị, thiết kế bản vẽ, đến quản lý dự án, đào tạo và hoàn thiện hồ sơ đăng ký chứng nhận. Đội ngũ chuyên gia đa ngành của GMPc, bao gồm các kiến trúc sư, kỹ sư, dược sĩ và chuyên gia có kinh nghiệm thực tế, cho phép họ thấu hiểu sâu sắc các yêu cầu kỹ thuật và quy trình vận hành.
Với hơn 14 năm kinh nghiệm, GMPc đã tư vấn thành công cho hơn 300 dự án nhà máy, chiếm hơn 80% tổng số nhà máy mới được xây dựng đạt chuẩn trong giai đoạn 2011 - 2025. Sự tin tưởng từ các đối tác lớn trong và ngoài nước như DHG Pharma, Nippon Chemiphar, hay Nhà máy vắc-xin Kyoto Biken là minh chứng rõ ràng cho năng lực và uy tín của GMPc.
Danh sách dự án tiêu biểu đạt tiêu chuẩn WHO GMP được GMPc Việt Nam tư vấn
CHƯƠNG IV: TỐI ƯU HÓA ĐẦU TƯ - LỢI ÍCH CỐT LÕI KHI HỢP TÁC CÙNG GMPC VIỆT NAM
Hợp tác với GMPc không chỉ là việc xây dựng một nhà máy, mà còn là một quyết định chiến lược mang lại nhiều lợi ích toàn diện:
Giảm thiểu rủi ro: Khách hàng được bảo vệ khỏi các rủi ro về pháp lý, kỹ thuật và tài chính. Đội ngũ GMPc đảm bảo mọi quy trình và hồ sơ đều tuân thủ các quy định hiện hành, tránh những sai sót có thể dẫn đến việc không được cấp chứng nhận.

Tiết kiệm thời gian và nguồn lực: Bằng cách trở thành "một đầu mối" duy nhất, GMPc giúp khách hàng giảm thiểu sự phức tạp khi phải làm việc với nhiều nhà thầu và đơn vị khác nhau.
Nâng cao năng lực cạnh tranh: Sở hữu một nhà máy đạt chuẩn quốc tế giúp doanh nghiệp không chỉ đáp ứng yêu cầu của thị trường trong nước mà còn mở rộng cơ hội xuất khẩu, nâng cao uy tín thương hiệu và chất lượng sản phẩm.
Kết Luận và Tầm Nhìn Tương Lai
Chặng đường phát triển của tiêu chuẩn GMP tại Việt Nam là một quá trình đầy thách thức nhưng cũng mở ra những cơ hội lớn. Từ việc chỉ tuân thủ các quy định cơ bản, ngành dược đang hướng tới một tầm vóc mới, trở thành một trung tâm sản xuất dược phẩm giá trị cao của khu vực, như mục tiêu trong Chiến lược Quốc gia đến năm 2045.
Trong hành trình chuyển mình đó, GMPc Việt Nam đã khẳng định vị thế của mình như một "người kiến tạo giải pháp," đồng hành cùng các doanh nghiệp từ những giai đoạn đầu tiên, giải quyết những điểm nghẽn và góp phần thúc đẩy sự phát triển bền vững của ngành. Với mô hình tư vấn trọn gói, đội ngũ chuyên gia giàu kinh nghiệm và sự cam kết về chất lượng, GMPc Việt Nam không chỉ giúp các nhà đầu tư đạt được chứng nhận mà còn tối ưu hóa toàn bộ quá trình đầu tư.
Sự tin tưởng của hàng trăm khách hàng và vị thế dẫn đầu trên thị trường là minh chứng rõ ràng nhất cho năng lực của GMPc. Đối với các nhà đầu tư đang tìm kiếm một đối tác tin cậy để hiện thực hóa dự án của mình, việc hợp tác với GMPc Việt Nam là một quyết định chiến lược để đảm bảo thành công và gia tăng giá trị, cùng nhau hiện thực hóa tầm nhìn đầy tham vọng của ngành dược Việt Nam.
GMPc Việt Nam đồng hành cùng doanh nghiệp dược Việt Nam trong chuẩn hóa EU GMP
Xu hướng EU-GMP/ PIC-S-GMP trong đấu thầu thuốc tại Việt Nam







