Trong bối cảnh công nghiệp dược phẩm hiện đại, việc kiểm soát chất lượng không thể chỉ dựa vào hoạt động kiểm nghiệm trên thành phẩm cuối cùng (End-product testing), do hạn chế về tính đại diện thống kê của mẫu thử. Để đảm bảo thuốc đạt tiêu chuẩn an toàn và hiệu quả một cách ổn định, các hướng dẫn GMP quốc tế (FDA, EMA, WHO) yêu cầu áp dụng Thẩm định quy trình (Process Validation).
Bài viết dưới đây của GMPc Việt Nam phân tích sâu về định nghĩa, mô hình tiếp cận theo vòng đời và các nguyên tắc thực hành thẩm định quy trình chuẩn mực.
1. Định nghĩa và Bản chất khoa học
Theo hướng dẫn của FDA (2011) và Phụ lục 3 của WHO, Thẩm định quy trình được định nghĩa là việc thu thập và đánh giá dữ liệu xuyên suốt từ giai đoạn thiết kế quy trình cho đến sản xuất thương mại. Mục đích là thiết lập bằng chứng khoa học chứng minh rằng quy trình có khả năng cung cấp sản phẩm chất lượng một cách nhất quán (consistency).
Bản chất của hoạt động này là chuyển dịch tư duy từ việc "kiểm tra chất lượng" sang "thiết kế chất lượng vào sản phẩm" (Quality by Design - QbD). Một quy trình được thẩm định thành công là quy trình đã được chứng minh khả năng kiểm soát các biến thiên để luôn tạo ra đầu ra đạt tiêu chuẩn, bất kể các dao động cho phép của đầu vào.
2. Mô hình tiếp cận theo Vòng đời (Lifecycle Approach)
Khác với quan điểm truyền thống coi thẩm định là một sự kiện đơn lẻ (thường là thực hiện 03 lô liên tiếp), các tiêu chuẩn GMP hiện hành áp dụng phương pháp tiếp cận theo vòng đời sản phẩm, bao gồm 3 giai đoạn liên kết chặt chẽ:
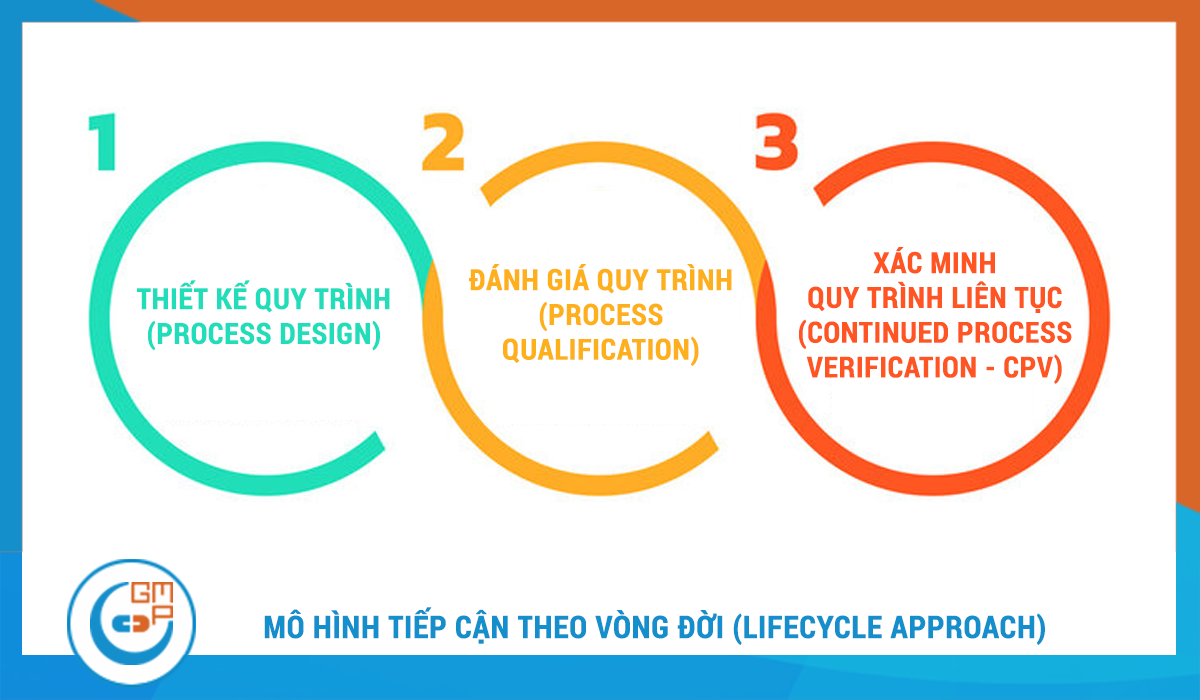
Giai đoạn 1: Thiết kế quy trình (Process Design)
Quy trình sản xuất thương mại được xác lập dựa trên cơ sở kiến thức thu được từ hoạt động Nghiên cứu và Phát triển (R&D).
- Mục tiêu: Xác định mối tương quan giữa các biến số đầu vào (nguyên liệu, thông số vận hành) và chất lượng đầu ra.
- Nội dung thực hiện:
+ Xác định các Thuộc tính chất lượng quan trọng (CQAs).
+ Xác định các Thông số quy trình quan trọng (CPPs) ảnh hưởng trực tiếp đến CQAs.
+ Thực hiện đánh giá rủi ro (Risk Assessment) để xây dựng Chiến lược kiểm soát (Control Strategy) cho toàn bộ dây chuyền.
Giai đoạn 2: Đánh giá quy trình (Process Qualification)
Giai đoạn này nhằm xác nhận thiết kế quy trình có khả năng vận hành hiệu quả và tái lập tại quy mô sản xuất thương mại. Giai đoạn này bao gồm hai thành phần chính:
1. Thiết kế và Đánh giá thiết bị / tiện ích
- IQ (Installation Qualification - Đánh giá lắp đặt): Xác nhận thiết bị và hệ thống phụ trợ được lắp đặt đúng thiết kế kỹ thuật và tuân thủ khuyến cáo của nhà sản xuất.
- OQ (Operational Qualification - Đánh giá vận hành): Xác nhận thiết bị hoạt động ổn định trong các giới hạn vận hành thiết kế, bao gồm cả các điều kiện cực hạn (worst-case).
2. Đánh giá hiệu năng quy trình (Process Performance Qualification - PPQ)
- Vận hành tích hợp quy trình với quy mô thương mại, bao gồm đầy đủ các yếu tố: thiết bị, con người, nguyên liệu và môi trường.
- Dữ liệu thu được phải chứng minh quy trình có tính năng lực (Process Capability) và độ đồng nhất giữa các lô (Batch-to-batch consistency).
Giai đoạn 3: Xác minh quy trình liên tục (Continued Process Verification - CPV)
Thẩm định không kết thúc sau khi lô PPQ cuối cùng được xuất xưởng. Nhà sản xuất phải đảm bảo quy trình luôn duy trì trong Trạng thái kiểm soát (State of control) suốt vòng đời thương mại.
- Phương pháp: Thiết lập chương trình thu thập và phân tích dữ liệu sản xuất, chất lượng định kỳ.
- Công cụ: Sử dụng các công cụ thống kê (như Biểu đồ kiểm soát - SPC) để giám sát biến thiên quy trình.
- Ý nghĩa: Phát hiện sớm các xu hướng trôi dạt (drift) hoặc biến động bất thường để thực hiện hành động khắc phục/phòng ngừa (CAPA) kịp thời.
3. Phân loại các hình thức Thẩm định quy trình
Căn cứ vào trạng thái sản phẩm và thời điểm thực hiện, hoạt động thẩm định được phân chia thành 4 loại chính như sau:

Thứ nhất là Thẩm định tiên nghiệm (Prospective Validation). Đây là loại thẩm định được thực hiện cho các công thức mới hoặc quy trình mới, và phải hoàn thành trước khi sản phẩm được phân phối ra thị trường. Đây là yêu cầu bắt buộc đối với hầu hết các sản phẩm dược phẩm mới hiện nay để đảm bảo an toàn tuyệt đối ngay từ đầu.
Thứ hai là Thẩm định hồi cứu (Retrospective Validation). Loại thẩm định này dành cho các sản phẩm đã được sản xuất từ lâu nhưng chưa được thẩm định chính thức. Chúng ta thực hiện bằng cách rà soát lại dữ liệu lịch sử của các lô đã sản xuất, bao gồm hồ sơ lô, biểu đồ kiểm soát, và sổ tay bảo trì. Tuy nhiên, phương pháp này hiện nay không còn được khuyến khích và ít được các cơ quan quản lý chấp nhận, vì rủi ro tiềm ẩn là rất cao.
Thứ ba là Thẩm định đồng thời (Concurrent Validation). Đây là trường hợp đặc biệt, khi việc thẩm định được thực hiện song song với quá trình sản xuất và phân phối thương mại. Tức là sản xuất đến đâu, giám sát và thẩm định đến đó. Hình thức này thường chỉ áp dụng cho các sản phẩm hiếm, thuốc mồ côi (orphan drugs), hoặc các lô sản xuất có tuổi thọ ngắn, cần đưa ra thị trường gấp và đã được cơ quan quản lý chấp thuận.
Thứ tư là Tái thẩm định (Revalidation). Chúng ta cần thực hiện lại quy trình thẩm định khi có bất kỳ sự thay đổi nào ảnh hưởng đến chất lượng sản phẩm. Ví dụ như: thay đổi nguồn cung cấp nguyên liệu, thay đổi thiết bị máy móc, thay đổi địa điểm nhà máy, hoặc thay đổi quy trình đóng gói. Ngoài ra, việc tái thẩm định cũng cần thực hiện định kỳ theo thời gian hoặc khi phát hiện các xu hướng sai lệch chất lượng lặp đi lặp lại.
4. Vai trò trong Hệ thống Quản lý Chất lượng (PQS)
Việc triển khai Thẩm định quy trình bài bản mang lại các giá trị cốt lõi cho doanh nghiệp dược phẩm:

- Tuân thủ pháp lý: Là yêu cầu bắt buộc để đạt chứng nhận GMP (WHO, EU, PIC/S) và duy trì giấy phép lưu hành sản phẩm.
- Kiểm soát biến thiên: Giảm thiểu sự dao động chất lượng giữa các lô, đảm bảo tính đồng đều của thành phẩm.
- Cơ sở cho điều tra sai lệch: Cung cấp dữ liệu gốc để phân tích nguyên nhân gốc rễ (Root Cause Analysis) khi xảy ra sự cố chất lượng (OOS/OOT).
- Hiệu quả kinh tế: Giảm thiểu chi phí chất lượng kém (chi phí hủy lô, tái chế), tối ưu hóa quy trình và cho phép giảm tần suất lấy mẫu kiểm nghiệm trong quá trình (IPC) khi quy trình đã ổn định.
Kết luận
Thẩm định quy trình là hoạt động kỹ thuật phức tạp, đòi hỏi sự đầu tư về nguồn lực, thời gian và chuyên môn sâu. Đây là nền tảng của Hệ thống Quản lý Chất lượng Dược phẩm, đảm bảo an toàn cho người bệnh và uy tín thương hiệu của nhà sản xuất.
GMPc Việt Nam cung cấp giải pháp tư vấn toàn diện về GMP, từ thiết kế nhà máy đến xây dựng hệ thống tài liệu và hướng dẫn thực hiện Thẩm định quy trình theo các tiêu chuẩn quốc tế khắt khe nhất.
GMPc Việt Nam – Đối tác chiến lược của Doanh nghiệp Dược phẩm
Website: www.gmp.com.vn
Email: contact@gmp.com.vn
Hotline CEO: 0982.866.668
Xem thêm:
Toàn Vẹn Dữ Liệu (Data Integrity) Trong Nhà Máy EU GMP: Hướng Dẫn Thực Thi Toàn Diện & Chiến Lược Số Hóa
Chiến Lược Thẩm Định (C&Q) Nhà Máy EU GMP: Rút Ngắn Tiến Độ & Tối Ưu Chi Phí







